Ο Άγγλος χημικός Τζων Ντάλτον γεννήθηκε σαν σήμερα το 1766
 |
| Το σημερινό θεωρητικό μοντέλο του ατόμου περιλαμβάνει ένα πυκνό πυρήνα που περιβάλλεται από ένα πιθανολογικό «σύννεφο» ηλεκτρονίων |
Ήταν πρωτοπόρος ερευνητής της αχρωματοψίας (Δαλτωνισμός).
Ο John Dalton ανακάλυψε ότι η πίεση των κορεσμένων ατμών ενός υγρού στο σημείο βρασμού έχει την ίδια τιμή για όλα τα υγρά και θεμελίωσε το νόμο των μερικών πιέσεων του Dalton. Σήμερα ξέρουμε ότι είναι 1 atm.
Ο Dalton δημοσίευσε για ποικίλα θέματα όπως η βροχή η δροσιά και η προέλευση των πηγών (υδροσφαιρία), για τη θερμότητα, το χρώμα του ουρανού, τον ατμό και την ανάκλαση και διάθλαση του φωτός. Αλλά και για την γραμματική όπως για τα βοηθητικά ρήματα και τις μετοχές της αγγλικής γλώσσας.
Τα πέντε κύρια σημεία της ατομικής θεωρίας του Ντάλτον
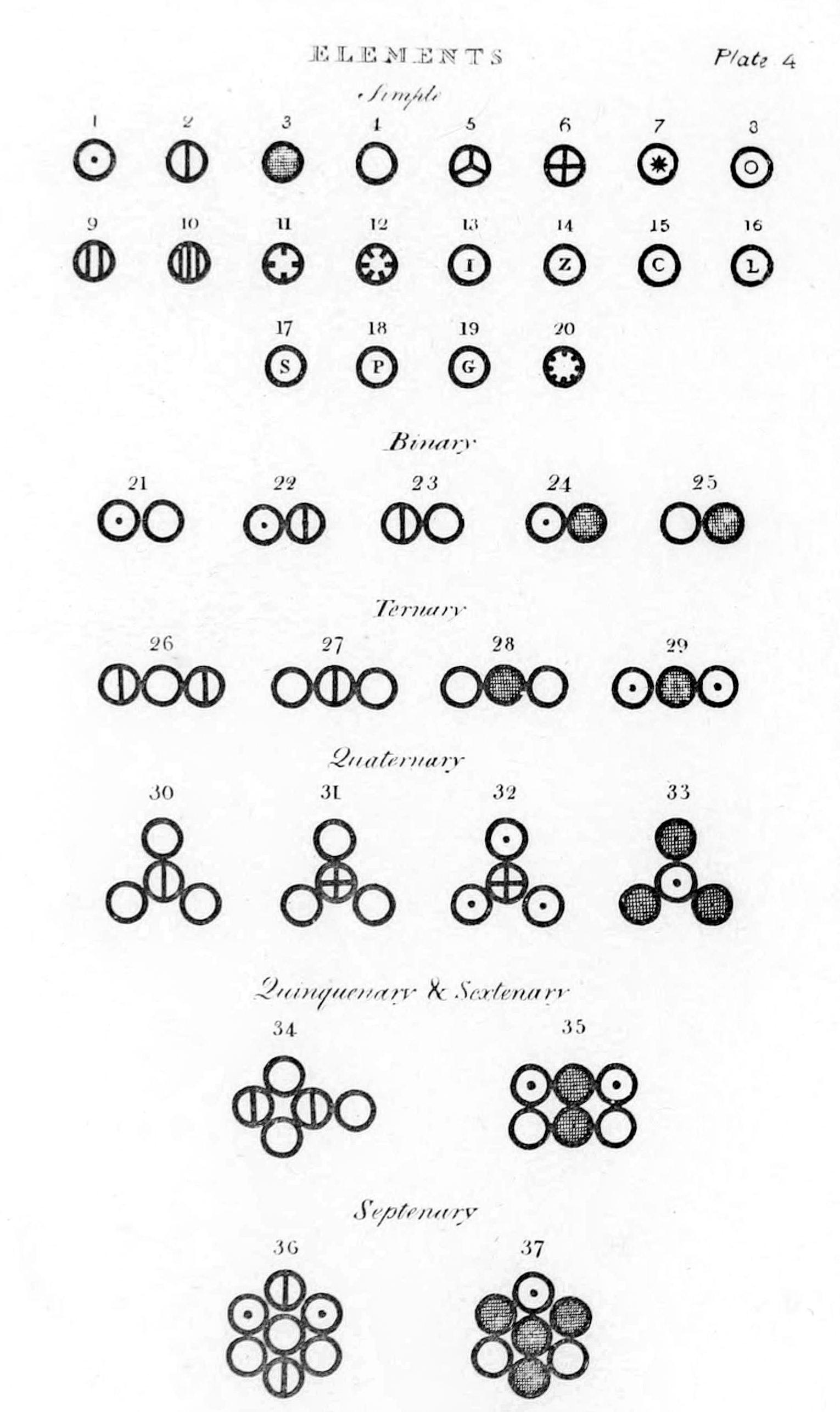 |
| Διάφορα άτομα και μόρια όπως απεικονίζεται στο νέο σύστημα χημικής φιλοσοφίας του John Dalton (1808).
Υπό: haade - En.wiki, Public Domain, wikimedia commons
|
- Τα στοιχεία αποτελούνται από εξαιρετικά μικρά σωματίδια που ονομάζονται άτομα.
- Τα άτομα ενός συγκεκριμένου στοιχείου είναι ίδια σε μέγεθος, μάζα, και άλλες ιδιότητες. Τα άτομα διαφορετικών στοιχείων διαφέρουν σε μέγεθος, μάζα, και άλλες ιδιότητες.
- Τα άτομα δεν μπορούν να υποδιαιρεθούν, να δημιουργηθούν ή να καταστραφούν.
- Άτομα διαφορετικών στοιχείων συνδυάζονται σε απλές ακέραιες αναλογίες για να σχηματίσουν χημικές ενώσεις.
- Στις χημικές αντιδράσεις, τα άτομα συνδυάζονται, διαχωρίζονται, ή αναδιατάσσονται.
Ο Ντάλτον πρότεινε έναν πρόσθετο «κανόνα μέγιστης απλότητας», ο οποίος δημιούργησε διαμάχες, δεδομένου ότι δεν μπορούσε να επιβεβαιωθεί.
Όταν τα άτομα συνδυάζονται σε μια μόνο αναλογία, «.. θα πρέπει να θεωρείται ότι είναι δυαδική, εκτός αν κάποιο αίτιο οδηγεί στο αντίθετο συμπέρασμα».
Αυτό ήταν απλώς μια υπόθεση προερχόμενη από την πίστη στην απλότητα της φύσης. Δεν υπήρχαν τότε διαθέσιμα αποδεικτικά στοιχεία ώστε οι επιστήμονες να συμπεράνουν πόσα άτομα από κάθε στοιχείο συνδυάζονται για να σχηματίσουν σύνθετα μόρια. Αλλά αυτός ή κάποιος άλλος τέτοιος κανόνας ήταν απολύτως απαραίτητος σε κάθε αρχική θεωρία, δεδομένου ότι χρειάζεται ένας υποτιθέμενος μοριακός τύπος, προκειμένου να υπολογιστούν τα σχετικά ατομικά βάρη. Σε κάθε περίπτωση, ο «κανόνας της μέγιστης απλότητας» του Ντάλτον τον ανάγκασε να υποθέσει ότι ο τύπος για το νερό ήταν ΟΗ και αμμωνίας ήταν NH, αρκετά διαφορετικά από τις σύγχρονες αντιλήψεις μας.
Από τη: Royal Society of Chemistry (RSC)
Εικόνα: By User:Yzmo - Own work, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=2246091
Εικόνα: By User:Yzmo - Own work, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=2246091