Η ναφθαλίνη σε συνηθισμένη θερμοκρασία μετατρέπεται από στερεό σε αέριο κατευθείαν χωρίς να λιώσει, εξαχνώνεται. Σε ποια θερμοκρασία ένα υλικό μετατρέπεται από στερεό σε υγρό (τήξη). Η ατμοσφαιρική πίεση παίζει ρόλο στη θερμοκρασία βρασμού. Μέσα στην χύτρα ταχύτητας το φαγητό βράζει σε μεγαλύτερη θερμοκρασία και όχι στη συνηθισμένη των 100οC. Σε όλα αυτά απαντάει το διάγραμμα φάσεων. Πρώτα όμως ας ανακεφαλαιώσουμε την έννοια της φυσικής κατάστασης μιας ουσίας και κατόπιν μπορούμε να μιλήσουμε για το διάγραμμα φάσεων.
Καταρχάς λοιπόν η φυσική κατάσταση είναι η κατάσταση στην οποία βρίσκεται ένα σώμα στην πραγματικότητα. Για παράδειγμα το νερό μπορεί να υπάρχει ως αέριο, υγρό ή στέρεο.
Στη στέρεη κατάσταση τα μόρια έχουν πολύ μικρή ελευθερία κινήσεων μπορούν μόνο να ταλαντώνονται γύρω από μία θέση ισορροπίας στον κρύσταλλο τους. Έτσι έχουμε ένα σύστημα (σύνολο μορίων) που έχει καθορισμένο σχήμα και καταλαμβάνει συγκεκριμένο όγκο.
Γενικά αν αυξήσουμε τη θερμοκρασία το σώμα θα περάσει σε υγρή κατ’ αρχάς και κατόπιν στην αέρια κατάσταση όπου τα μόρια έχουν την μεγαλύτερη ελευθερία κινήσεων. Στην υγρή κατάσταση τα μόρια κινούνται ελεύθερα μέσα σε όλο το χώρο του υγρού. Οι ελκτικές δυνάμεις που ασκούνται μεταξύ τους δεν είναι αρκετά ισχυρές ώστε να υπερισχύσουν της θερμικής κίνησης και να συγκρατήσουν τα μόρια σε θέσεις ισορροπίας όπως στην στερεά κατάσταση, στον κρύσταλλο. Έτσι τα μόρια απελευθερώνονται από το κρυσταλλικό πλέγμα. Το σώμα υιοθετεί το σχήμα του δοχείου μέσα στο οποίο περιέχεται, αλλά ο χώρος που καταλαμβάνει (ο όγκος του) παραμένει περίπου ίδιος με τον όγκο του στερεού.
Αν στο σύστημά μας προσφέρουμε και άλλη ενέργεια, αυξήσουμε τη θερμοκρασία, τότε τα μόρια θα έχουν τόση ορμή (ταχύτητα x μάζα) που οι ελκτικές μεταξύ τους δυνάμεις δεν θα επαρκούν για να τα συγκρατήσουν μέσα στον χώρο του υγρού και περνάνε έξω από αυτόν σε όλο το διαθέσιμο χώρο. Τώρα το σώμα έχει χάσει και το αρχικό σχήμα αλλά και τον αρχικό όγκο.
Ας σημειώσουμε τέλος ότι εκτός από αυτές τις τρεις καταστάσεις της ύλης υπάρχει και μια τέταρτη, η κατάσταση πλάσματος.
Έτσι έχουμε αυτό το διάγραμμα όπου στον οριζόντιο άξονα είναι η θερμοκρασία (Temperature), σε μονάδες Κελσίου και στον κάθετο άξονα, έχουμε πίεση (Pressure) σε μονάδες Πασκάλ.
Όπως μόλις είπαμε, έχουμε τρεις διαφορετικές φυσικές καταστάσεις. Για το νερό φαίνεται σε αυτό το διάγραμμα ότι σε υψηλή θερμοκρασία - αυτή είναι η φάση υψηλής θερμοκρασίας - και χαμηλή πίεση, το νερό θα υπάρχει ως αέριο. Αυτή είναι η περιοχή του αερίου, δίπλα στον άξονα των χ, τον οριζόντιο άξονα, τον άξονα της θερμοκρασίας..
Και σε χαμηλή θερμοκρασία και υψηλή πίεση, δίπλα στον άξονα των ψ, τι υπάρχει; Στερεό. Αυτή είναι η περιοχή του στερεού.
Σε ενδιάμεσες θερμοκρασία και πίεση,το νερό θα υπάρχει ως υγρό.
Αυτό είναι ότι συνήθως βλέπουμε χοντρικά σε ένα διάγραμμα φάσεων. Αλλά υπάρχουν και μερικά άλλα ενδιαφέροντα σημεία στο διάγραμμα φάσεων.
Όπως μπορούμε να δούμε πως (σε ποιες θερμοκρασίες και πιέσεις) η μια κατάσταση μετασχηματίζεται στην άλλη. Έτσι έχουμε τρεις διαφορετικές γραμμές εδώ. Την κόκκινη την μπλε και την πράσινη. Η κάθε γραμμή αντιπροσωπεύει όλα τα ζεύγη θερμοκρασίας-πίεσης όπου δύο φάσεις μπορούν να συνυπάρχουν.
Έτσι, για παράδειγμα, όλοι ξέρουμε ότι στους 100 βαθμούς Κελσίου και στα 101.325 κιλοπασκάλ (δηλαδή σε πίεση 1 atm) το νερό βράζει δηλαδή μπορεί να υπάρχει ταυτόχρονα ως αέριο και υγρό. Σε χαμηλότερη πίεση π.χ. στην κορυφή του Έβερεστ το νερό θα βράσει σε χαμηλότερη θερμοκρασία. Όλα αυτά τα ζεύγη (θερμοκρασίας, πίεσης) μας δίνουν την μπλε γραμμή.
Αντίστοιχα υπάρχει και η κόκκινη γραμμή που διαχωρίζει την περιοχή του αερίου από τη περιοχή του στερεού και επίσης η πράσινη γραμμή όπου συνυπάρχουν στερεό και αέριο. Η διακεκομμένη γραμμή δείχνει την ανώμαλη συμπεριφορά του νερού.
Επίσης αξίζει να σημειώσουμε το τριπλό σημείο. Το σημείο όπου τέμνονται οι τρεις γραμμές. Σε αυτή τη θερμοκρασία και πίεση συνυπάρχουν και οι τρεις καταστάσεις στερεό-υγρό-αέριο. Για το νερό το τριπλό σημείο είναι στους 0,01οC και στις 0,006 atm.
Τέλος στο διάγραμμα βλέπουμε και ένα άλλο σημείο, το critical point δηλαδή κρίσιμο σημείο. Σε θερμοκρασίες και πιέσεις πάνω απο τις κρίσιμες (Tcr και Pcr) η υγρή και αέρια κατάσταση συνυπάρχουν χωρίς να βλέπουμε σαφή όρια μεταξύ τους. Έχουμε δηλαδή ένα μείγμα υγρού-αερίου που δεν μπορούμε να αποφασίσουμε εάν είναι υγρό ή αέριο και γι’ αυτό το ονομάζουμε υπερκρίσιμο ρευστό (supercritical fluid).
Τα διαγράμματα φάσεων αποτελούν τον ακρογωνιαίο λίθο της γνώσης στην επιστήμη και τεχνολογία των υλικών. Αποτελούν τον τέλειο οδικό χάρτη και το σημείο εκκίνησης για το σχεδιασμό όλων των ειδών των υλικών, όπως κράματα, κεραμικά, ημιαγωγούς, τσιμέντο, σκυρόδεμα, ή οποιοδήποτε υλικό, όπου η υπάρχει η έννοια της φάσης. Είναι επίσης χρήσιμα για τη βελτιστοποίηση διαδικασιών, όπως η τήξη, χύτευση, ανάπτυξη κρυστάλλων, κολήσεις, αντιδράσεις στερεάς κατάστασης , θερμική επεξεργασία / μετατροπή φάσης, οξείδωση, απόθεση ατμού, και ούτω καθεξής.
“Τα διαγράμματα φάσεως είναι η αρχή της σοφίας και όχι το τέλος” λέει αποφθεγματικά ο Σερ William Hume-Rothery (1899-1968) Άγγλος μεταλλουργός διάσημος για τους “κανόνες Hume-Rothery” στη δημιουργία κραμάτων.
Το MIT (Massachusetts Institute of Technology) σε μια σειρά μαθημάτων στο διαδίκτυο αναφέρεται στο διάγραμμα φάσεων:
A. Kemp. RES.21G-001 The User-friendly Classroom. Spring 2016. Massachusetts Institute of Technology: MIT OpenCourseWare, https://ocw.mit.edu. License: Creative Commons BY-NC-SA.
Πηγές:
https://en.wikipedia.org/wiki/Phase_diagram
https://en.wikipedia.org/wiki/Triple_point
https://en.wikipedia.org/wiki/State_of_matter
Οι καταστάσεις της ύλης.
 |
| By Spirit469 - Own work, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=23549036 |
Στη στέρεη κατάσταση τα μόρια έχουν πολύ μικρή ελευθερία κινήσεων μπορούν μόνο να ταλαντώνονται γύρω από μία θέση ισορροπίας στον κρύσταλλο τους. Έτσι έχουμε ένα σύστημα (σύνολο μορίων) που έχει καθορισμένο σχήμα και καταλαμβάνει συγκεκριμένο όγκο.
Γενικά αν αυξήσουμε τη θερμοκρασία το σώμα θα περάσει σε υγρή κατ’ αρχάς και κατόπιν στην αέρια κατάσταση όπου τα μόρια έχουν την μεγαλύτερη ελευθερία κινήσεων. Στην υγρή κατάσταση τα μόρια κινούνται ελεύθερα μέσα σε όλο το χώρο του υγρού. Οι ελκτικές δυνάμεις που ασκούνται μεταξύ τους δεν είναι αρκετά ισχυρές ώστε να υπερισχύσουν της θερμικής κίνησης και να συγκρατήσουν τα μόρια σε θέσεις ισορροπίας όπως στην στερεά κατάσταση, στον κρύσταλλο. Έτσι τα μόρια απελευθερώνονται από το κρυσταλλικό πλέγμα. Το σώμα υιοθετεί το σχήμα του δοχείου μέσα στο οποίο περιέχεται, αλλά ο χώρος που καταλαμβάνει (ο όγκος του) παραμένει περίπου ίδιος με τον όγκο του στερεού.
Αν στο σύστημά μας προσφέρουμε και άλλη ενέργεια, αυξήσουμε τη θερμοκρασία, τότε τα μόρια θα έχουν τόση ορμή (ταχύτητα x μάζα) που οι ελκτικές μεταξύ τους δυνάμεις δεν θα επαρκούν για να τα συγκρατήσουν μέσα στον χώρο του υγρού και περνάνε έξω από αυτόν σε όλο το διαθέσιμο χώρο. Τώρα το σώμα έχει χάσει και το αρχικό σχήμα αλλά και τον αρχικό όγκο.
Ας σημειώσουμε τέλος ότι εκτός από αυτές τις τρεις καταστάσεις της ύλης υπάρχει και μια τέταρτη, η κατάσταση πλάσματος.
Διάγραμμα φάσεων.
Το διάγραμμα φάσεων είναι ένα διάγραμμα όπου μπορούμε να δούμε ποια είναι η φυσική κατάσταση ενός σώματος για δεδομένες συνθήκες θερμοκρασίας και πίεσης. Έτσι, ένα διάγραμμα φάσεων είναι ένα εργαλείο για μηχανικούς ή επιστήμονες για να ερμηνεύουν ή να βρίσκουν πολύ εύκολα την φυσική κατάσταση μιας ουσίας σε μια ορισμένη θερμοκρασία και πίεση.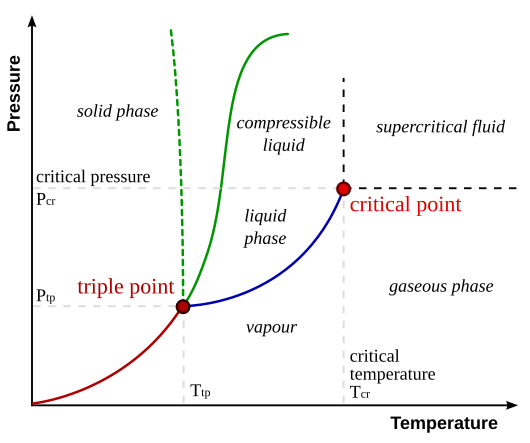 |
| Διάγραμμα φάσεων. By Matthieumarechal, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=4623701 |
Έτσι έχουμε αυτό το διάγραμμα όπου στον οριζόντιο άξονα είναι η θερμοκρασία (Temperature), σε μονάδες Κελσίου και στον κάθετο άξονα, έχουμε πίεση (Pressure) σε μονάδες Πασκάλ.
Όπως μόλις είπαμε, έχουμε τρεις διαφορετικές φυσικές καταστάσεις. Για το νερό φαίνεται σε αυτό το διάγραμμα ότι σε υψηλή θερμοκρασία - αυτή είναι η φάση υψηλής θερμοκρασίας - και χαμηλή πίεση, το νερό θα υπάρχει ως αέριο. Αυτή είναι η περιοχή του αερίου, δίπλα στον άξονα των χ, τον οριζόντιο άξονα, τον άξονα της θερμοκρασίας..
Και σε χαμηλή θερμοκρασία και υψηλή πίεση, δίπλα στον άξονα των ψ, τι υπάρχει; Στερεό. Αυτή είναι η περιοχή του στερεού.
Σε ενδιάμεσες θερμοκρασία και πίεση,το νερό θα υπάρχει ως υγρό.
Αυτό είναι ότι συνήθως βλέπουμε χοντρικά σε ένα διάγραμμα φάσεων. Αλλά υπάρχουν και μερικά άλλα ενδιαφέροντα σημεία στο διάγραμμα φάσεων.
Όπως μπορούμε να δούμε πως (σε ποιες θερμοκρασίες και πιέσεις) η μια κατάσταση μετασχηματίζεται στην άλλη. Έτσι έχουμε τρεις διαφορετικές γραμμές εδώ. Την κόκκινη την μπλε και την πράσινη. Η κάθε γραμμή αντιπροσωπεύει όλα τα ζεύγη θερμοκρασίας-πίεσης όπου δύο φάσεις μπορούν να συνυπάρχουν.
Έτσι, για παράδειγμα, όλοι ξέρουμε ότι στους 100 βαθμούς Κελσίου και στα 101.325 κιλοπασκάλ (δηλαδή σε πίεση 1 atm) το νερό βράζει δηλαδή μπορεί να υπάρχει ταυτόχρονα ως αέριο και υγρό. Σε χαμηλότερη πίεση π.χ. στην κορυφή του Έβερεστ το νερό θα βράσει σε χαμηλότερη θερμοκρασία. Όλα αυτά τα ζεύγη (θερμοκρασίας, πίεσης) μας δίνουν την μπλε γραμμή.
Αντίστοιχα υπάρχει και η κόκκινη γραμμή που διαχωρίζει την περιοχή του αερίου από τη περιοχή του στερεού και επίσης η πράσινη γραμμή όπου συνυπάρχουν στερεό και αέριο. Η διακεκομμένη γραμμή δείχνει την ανώμαλη συμπεριφορά του νερού.
Επίσης αξίζει να σημειώσουμε το τριπλό σημείο. Το σημείο όπου τέμνονται οι τρεις γραμμές. Σε αυτή τη θερμοκρασία και πίεση συνυπάρχουν και οι τρεις καταστάσεις στερεό-υγρό-αέριο. Για το νερό το τριπλό σημείο είναι στους 0,01οC και στις 0,006 atm.
Τέλος στο διάγραμμα βλέπουμε και ένα άλλο σημείο, το critical point δηλαδή κρίσιμο σημείο. Σε θερμοκρασίες και πιέσεις πάνω απο τις κρίσιμες (Tcr και Pcr) η υγρή και αέρια κατάσταση συνυπάρχουν χωρίς να βλέπουμε σαφή όρια μεταξύ τους. Έχουμε δηλαδή ένα μείγμα υγρού-αερίου που δεν μπορούμε να αποφασίσουμε εάν είναι υγρό ή αέριο και γι’ αυτό το ονομάζουμε υπερκρίσιμο ρευστό (supercritical fluid).
Τα διαγράμματα φάσεων αποτελούν τον ακρογωνιαίο λίθο της γνώσης στην επιστήμη και τεχνολογία των υλικών. Αποτελούν τον τέλειο οδικό χάρτη και το σημείο εκκίνησης για το σχεδιασμό όλων των ειδών των υλικών, όπως κράματα, κεραμικά, ημιαγωγούς, τσιμέντο, σκυρόδεμα, ή οποιοδήποτε υλικό, όπου η υπάρχει η έννοια της φάσης. Είναι επίσης χρήσιμα για τη βελτιστοποίηση διαδικασιών, όπως η τήξη, χύτευση, ανάπτυξη κρυστάλλων, κολήσεις, αντιδράσεις στερεάς κατάστασης , θερμική επεξεργασία / μετατροπή φάσης, οξείδωση, απόθεση ατμού, και ούτω καθεξής.
“Τα διαγράμματα φάσεως είναι η αρχή της σοφίας και όχι το τέλος” λέει αποφθεγματικά ο Σερ William Hume-Rothery (1899-1968) Άγγλος μεταλλουργός διάσημος για τους “κανόνες Hume-Rothery” στη δημιουργία κραμάτων.
Το MIT (Massachusetts Institute of Technology) σε μια σειρά μαθημάτων στο διαδίκτυο αναφέρεται στο διάγραμμα φάσεων:
A. Kemp. RES.21G-001 The User-friendly Classroom. Spring 2016. Massachusetts Institute of Technology: MIT OpenCourseWare, https://ocw.mit.edu. License: Creative Commons BY-NC-SA.
Πηγές:
https://en.wikipedia.org/wiki/Phase_diagram
https://en.wikipedia.org/wiki/Triple_point
https://en.wikipedia.org/wiki/State_of_matter